Quatre nouvelles espèces d’invertébrés exotiques observées sur le Rhône
Par Jean-François Fruget (ARALEP), avec la contribution de Jean-Nicolas Beisel (ENGEES)
De nouvelles espèces exotiques sont rencontrées de manière récurrente au sein de la faune des macroinvertébrés du Rhône. Ces deux dernières années, quatre espèces qui n’y avaient jamais été observées, dont deux qui seraient des premières citations pour la France ou a minima pour le grand quart sud-est, ont été découvertes. Ainsi, dans le cadre des études menées sur l’aménagement hydroélectrique de Péage-de-Roussillon et aux environs du centre nucléaire de production d’électricité de Saint-Alban situé à une cinquantaine de kilomètres en aval de Lyon, nous avons successivement vu apparaître dans nos prélèvements la Sangsue Barbronia weberi (septembre 2014), le Polychète Manayunkia caspica (novembre 2014), le Gammare Dikerogammarus haemobaphes (avril 2016) et le Bivalve Dreissena rostriformis bugensis (avril 2016). Les annélides B. weberi et M. caspica sont depuis deux ans constamment présents dans nos échantillons avec des abondances variables. B. weberi a également été rencontrée en 2015 sur le Rhône en amont de Lyon au voisinage du CNPE du Bugey (soit environ 45 km en amont de la confluence Rhône-Saône). Hormis la sangsue, les trois autres espèces ont en commun leur origine ponto-caspienne, avec le Danube et le canal Main-Danube comme voie d’expansion probable vers l’Europe de l’ouest.
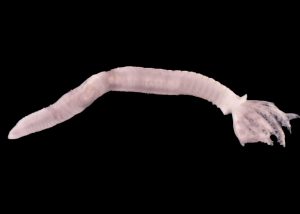
Barbronia weberi Blanchard, 1897
- Première observation à Péage-de-Roussillon en septembre 2014 avec une dizaine d’individus sur le Rhône court-circuité (substrat grossier de type galets) et présente à partir de 2015 sur la retenue (substrat à tendance limoneuse) avec à chaque fois quelques individus (< 5). Première observation à Bugey en 2015, en particulier à l’aval immédiat du rejet d’eau réchauffée (de 10 à 15 individus à cette station, quelques individus épars aux autres stations), sur des substrats grossiers (galets)
- Espèce de sangsue la plus commune du continent asiatique, successivement présente depuis le courant des années 1970 en Nouvelle-Zélande, Grande-Bretagne, Autriche et Allemagne, Brésil, Etats-Unis, probablement via l’aquariophilie (Genoni & Fazzone, 2008).
- Peut être associée à la végétation aquatique qui lui sert de support de ponte.Prédatrice d’autres invertébrés.
- Coexiste souvent avec Helobdella stagnalis en exploitant, à côté des chironomes, proies communes aux deux espèces, des proies secondaires différentes (mollusques, oligochètes).
- Favorisée, comme de nombreuses espèces tropicales, par les rejets thermiques (Pavluk et al., 2011).
- Se différencie d’Erpobdella octoculata par la présence de 4 pores génitaux (au lieu de 2) et des yeux au nombre de 6 implantés différemment (8 chez Erpodella).
Manayunkia caspica Annenkova, 1928
- Observation de plusieurs centaines d’individus dès la première capture de cette espèce, en novembre 2014, dans des prélèvements effectués par dragage dans la retenue au droit du site de St-Alban. Elle y est dorénavant échantillonnée régulièrement mais seulement de quelques individus à une quarantaine maximum.
- Comme beaucoup de Polychètes, l’espèce affectionne les substrats limoneux. Elle est caractéristique du potamon et supporte les milieux saumâtres (Jakovcev-Todorovic et al., 2006). Ces derniers auteurs signalent la rareté de la littérature concernant cette espèce.
- Initialement mentionnée comme étant Laonome calida (une espèce australienne), la correction a été faite non pas sur des critères morphologiques (les deux espèces se ressemblant fortement et seule la génétique et la microscopie électronique pouvant les différencier), mais sur la probabilité d’occurrence (L. calida a été uniquement mentionnée aux Pays-Bas et non confirmée – Capa et al., 2014).
- Se différencie d’Hypania invalida, avec laquelle elle vit en sympatrie dans le cours aval du Danube, par la couronne de tentacules très importante chez Manayunkia alors qu’Hypania ne présente qu’une trompe avec quelques branchies.
Dikerogammarus haemobaphes, Eichwald, 1841
- Une quarantaine d’individus au total capturés en avril 2016 dans des prélèvements par substrats artificiels rivulaires sur la retenue tant en amont qu’en aval du CNPE de St-Alban. Milieu à tendance limoneuse avec présence de végétation aquatique.
- En expansion progressive en Europe centrale et en Europe de l’ouest depuis les années 1950 (Bacela et al., 2009 ; Wozniczka et al., 2016).
- Facilité par sa maturité sexuelle précoce, sa forte fécondité et son temps de génération réduit, sa plasticité alimentaire.
- Signalée jusqu’à maintenant uniquement dans le quart nord-est de la France (Labat et al., 2011 ; Piscart & Bollache, 2012).
- Se différencie de D. villosus par les pointes de l’urosome, moins grandes et inclinées vers l’arrière ; l’uropode 3, avec des épines tant sur les bords internes qu’externes ; la brosse, réduite, sur l’antenne 2 des mâles ; la longueur des soies, courtes, des gnathopodes mâles (Eiseler, 2010).
Dreissena rostriformis bugensis, Andrusov, 1897
- Capture de plus de 600 individus par dragage du substrat grossier (galets) du chenal du canal de fuite de l’aménagement de Péage-de-Roussillon en avril 2016 (1 individu également dans le chenal du Rhône court-circuité – galets -, 6 individus dans celui de la retenue – limon argileux et galets -).
- Originellement native du bas cours du Dniepr, la moule quagga a progressé aux cours des dernières décades vers la Russie d’un côté, le Danube roumain puis l’Europe de l’ouest de l’autre (Marescaux et al., 2016), et a envahi les Grands Lacs nord-américains à la fin des années 1980 concomitamment à la moule zébrée D. polymorpha et très probablement à l’état larvaire dans les ballastes des navires (van der Velde & Platvoet, 2007). Des scénarios basés sur des outils génétiques montrent qu’il est probable qu’une part au moins de l’invasion d’écosystèmes dans l’ouest de l’Europe provienne des Grands Lacs nord-américains (Marescaux et al., 2016).
- Signalée en 2011 sur la Moselle et la Meuse (bij de Vaate & Beisel, 2011, Marescaux et al., 2012 et 2015).
- D’écologie similaire à D. polymorpha, elle présenterait toutefois une meilleure tolérance à des mauvaises conditions de nourriture et à des fortes températures.
- Se distingue de D. polymorpha par sa carène arrondie (pas de côté plat), sa suture ventrale dissymétrique, les valves gauche et droite étant ainsi différentes.
Perspectives
Ces différentes espèces peuvent facilement être confondues avec d’autres déjà présentes. Les clés de détermination classiquement utilisées ne les différencient pas hormis l’espèce D. haemobaphes qui est inclue dans la clé de Piscart & Bollache (2012). La résolution taxonomique des études et suivis ne permet pas toujours de savoir quelles espèces sont présentes et nous recommandons un effort d’identification de ces espèces en particulier car leurs effets potentiels sur le milieu aquatique méritent d’être mieux appréhendés. Une meilleure compréhension de leurs impacts passe par l’observation fine de leur répartition, densité et préférendums écologiques.
Pour en savoir plus
- Jean-François Fruget (ARALEP) : fruget@aralep.com
- Jean-Nicolas Beisel (ENGEES) : jn.beisel@engees.unistra.fr
Bibliographie
- Bacela K., Konopacka A. & Grabowski M., 2009. Reproductive biology of Dikerogammarus haemobaphes: an invasive gammarid (Crustacea: Amphipoda) colonizing running waters in Central Europe. Biological Invasions, 11 (9), 2055-2066.
- bij de Vaate A. & Beisel J.N., 2011. Range expansion of the quagga mussel Dreissena rostriformis bugensis (Andrusov, 1897) in Wertern Europe : first observation from France. Aquatic Invasions, 6, suppl. 1, S71-S74.
- Capa M., van Moorsel G. & Templeman D., 2014. The Australian feather-duster worm Laonome calida Capa, 2007 (Annelida : Sabellidae) introduced into European inland waters ? BioInvasions Records, 3 (1), 1-11.
- Eiseler B., 2010. Taxonomie für die Praxis. Bestimmungshilfen – Makrozoobenthos (1). LANUV-Arbeitsblatt 14, 181 pp.
- Genoni P. & Fazzone A., 2008. Barbronia weberi (R. Blanchard, 1897) (Hirudinea : Salifidae), an Asian leech species new to Italy. Aquatic Invasions, 3 (1), 77-79.
- Jakovcev-Todorovic D., Dikanovic V., Milosevic S. & Cakic P., 2006. Discovery of Polychaete species Manayunkia caspia (Annenkova, 1929) in the Serbian sector of the Danube. Arch. Biol. Sci., Belgrade, 58 (4), 35-36.
- Labat F., Piscart C. & Fontan B., 2011. First records, pathways and distributions of four new Ponto-Caspian amphipods in France. Limnologica – Ecology and Management of Inland Waters, 41 (4), 290-295.
- Marescaux J., Boets P., Lorquet J., Sablon R., Van Doninck K, 2012. First records of the quagga mussel, Dreissena rostriformis bugensis (Andrusov, 1897) in the Meuse River within France. BioInvasions Records, 1 (4), 273-276.
- Marescaux J., Molloy D.P., Giamberini L., Albrecht C. & Van Doninck K & Beisel J.N., 2015. Sympatric Dreissena species in the Meuse River : towards a dominance shift from zebra to quagga mussels. Aquatic Invasions, 10 (3), 287–298.
- Marescaux, J., von Oheimb, K. C., Etoundi, E., von Oheimb, P. V., Albrecht, C., Wilke, T., & Van Doninck, K. (2016). Unravelling the invasion pathways of the quagga mussel (Dreissena rostriformis) into Western Europe. Biological Invasions, 18(1), 245-264.
- Pavluk T., Pavluk E. & Rasines R., 2011. First record of the Asian leech Barbronia weberi (R. Blanchard, 1897) (Hirudinea : Arhynchobdellida : Erpobdelliformes : Salifidae), in the Iberian Peninsula. Aquatic Invasions, 6 (1), S61-S64.
- Piscart C. & Bollache L., 2012. Crustacés amphipodes de surface (Gammares d’eau douce). AFL éd., Thonon-les-Bains, 113 pp.
- van der Velde G. & Platvoet D., 2007. Quagga mussels Dreissena rostriformis bugensis (Andrusov, 1897) in the Main River (Germany). Aquatic Invasions, 2 (3), 261-264.
- Wozniczka A., Wawrzyniak-Wydrowska B., Radziejewska T. , Skrzypacz A., 2016. The quagga mussel (Dreissena rostriformis bugensis Andrusov, 1897) — another Ponto-Caspian dreissenid bivalve in the southern Baltic catchment: the first record from the Szczecin Lagoon . Oceanologia (2016) 58, 154-159.